Como en este tema vamos a entrar a los tipos de enlaces que existen .Antes de poder explicar los tipos de enlaces que hay deberíamos explicar porque se enlazan entre sí
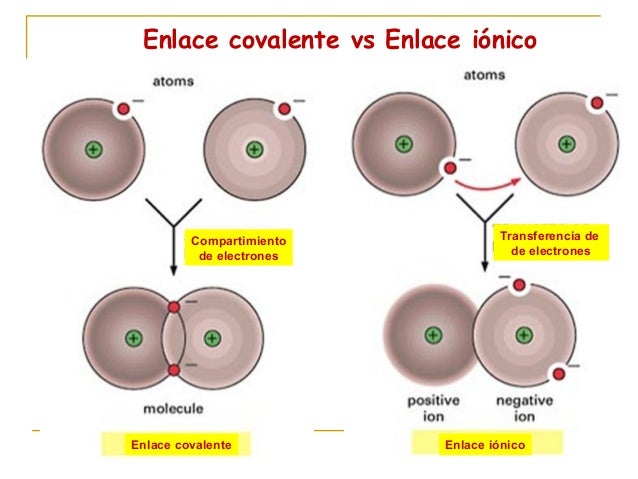
Enlace covalente
Enlace iónico
Enlace metálico
Una de las formas de que los átomos alcancen 8 electrones su última capa es compartir los electrones con otros átomos, estación de compartir los átomos es lo que se llama enlace covalente, si se comparte únicamente un par de electrones hablamos de un enlace simple, si se comparten drones entonces es un enlace doble y por último si se comparten tres pares de electrones es un enlace triple.
Un enlace iónico es un enlace que se da por una atracción eléctrica entre iones, exactamente entre cationes procedentes del metal que tienen carga positiva y aniones procedentes del no metal que tienen carga negativa.
Una cosa que deberíamos de saber es que los metales tienden y los no metales tienden a captarlos.
Por lo tanto la formación de un compuesto iónico ocurre cuando un metal cede electrones convirtiéndose en un catión y él no metal capta convirtiéndose en un anión. Los cationes y aniones formados mantienen después unidos entre sí mediante una atracción electrostática formando así una red cristalina perfectamente ordenada.
Esta propiedad se consigue gracias a que los electrones del enlace metálico tienen una gran libertad y facilidad de movimiento.
Para qué un compuesto metálico tenga esta características tienes que tener primero dos condiciones a nivel atómico.
La primera es que la energia de ionizacion sea baja, es decir, que la energía necesaria para arrancar un electrón de la capa de valencia sea baja y la segunda condición es que posea orbitales de valencia vacíos y accesibles que permita al electrón moverse con facilidad.
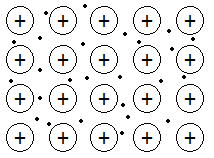
El enlace metálico se explica mediante la teoría del gas electrónico también conocida cómo nube electrónica, esta teoría dice que los átomos metálicos pierden los electrones de valencia y forman una red compacta de cationes.
Estos electrones no pertenecen los átomos individuales sino que son comunes a todos los átomos que forman la red o nube electrónica. Se dice que los electrones están deslocalizados.
Dependiendo del número de electrones de valencia que tenga el metal habrá cuántos electrones deslocalizados como átomos o más.
Los cationes se disponen formando un retículo cristalino compacto y cada catión se rodea de el máximo número de cationes posibles. Los electrones de valencia se mueven libremente por la nube electrónica formando así el gas electrónico y actuando para evitar la repulsión de los distintos cationes.
Dada la libertad de los electrones de valencia la teoría del enlace metálico explica muy bien la mayoría de las propiedades metálicas cómo puede ser la buena conductividad eléctrica y térmica.
Se puede ver claramente el porque el material es dúctil y maleable ; ya que las capas de cationes pueden deslizarse unas sobre otras manteniendo el tipo de estructura y fortaleciendo el enlace.
Características de los materiales metálicos
Los metales tienen una serie de propiedades mecánicas qué hacen que este material tenga una gran importancia en todo tipo de industrias. Y sus características son las siguientes:
- Forman redes cristalinas metálicas en las que el catión se encuentra perfectamente ordenados en el espacio
- Presentan una elevada densidad ya que los cationes están organizados de manera compacta.
- Tienen elevada térmica y eléctrica ya que los electrones tienen una gran movilidad en la capa de valencia, como ya hemos visto en la explicación de los enlaces metálicos.
- Otra característica importante es la gran deformabilidad que tienen ya que las capas de cationes se pueden desplazar entre sí sin altere su estructura. Un ejemplo es que se pueden estirar como hilos como el cobre cuya propiedad recibe el nombre de ductibilidad y tambien se puede laminar como el aluminio y esta propiedad se llama maleabilidad.
- Algo que caracteriza mucho a los metales es su alto punto de fusión y ebullición es decir que hace falta una gran cantidad de energía para separar los átomos que forman la estructura. Aunque sus puntos de fusión varían notablemente dentro de un intervalo muy amplio.Un el mercurio a temperatura ambiente es líquido, y el galio funde a 29 grados y el Wolfram yo a 3380 grados.
- Tienen un brillo metálico y la mayoría de los metales no absorbe ninguna radiación luminosa sino que la refleja en su totalidad.
- Los metales pueden emitir electrones al ser irradiados con una radiación de la frecuencia adecuada y del mismo modo este fenómeno puede ocurrir por el calor y recibe el nombre de termoionico.
A estas propiedades interesantes para la fabricación de materiales se les unen otras más específicas de ciertos metales, cómo por ejemplo las propiedades magnéticas ciertos metales y el coste reducido de algunos metales.
Lo normal es dividir los metales en dos grandes grupos: ferrosos que contienen como elemento principal el hierro y los no ferrosos que comprenden los demás. El hierro y el acero son metales ferrosos.. Mientras que en el grupo de los no ferrosos se encuentran el zinc, plomo, aluminio, cobre, estaño.
La estructura de los metales
Un trozo de metal contiene millones cristales denominados granos cada grano posee una única estructura de red cristalina, pero los diversos granos están orientados aleatoriamente en el metal. Cuándo solidifica va formando granos en posiciones aleatorias y a medida que se enfría dichos granos van creciendo y uniéndose unos con otros.Así forman así fronteras de grano.
El tamaño, la forma y orientación de los granos es un factor de dominante en las propiedades mecánicas del metal. Los granos más pequeños proporcional por regla general mayor dureza y resistencia a la rotura así como una mejor ductibilidad y acabado superficial. El proceso de solidificacion influye en buena medida en el tamaño del grano, ya que una solidificación rápida da lugar a un grano más pequeño y una solidificación rápida da lugar a granos más grandes.
Redes cristalinas de los metales
En los metales los átomos se ordenan formando redes tridimensionales ocupando posiciones de equilibrio en los vértices de determinadas formas geométricas.
A la agrupación elemental de átomos se la conoce como celda unitaria cómo ir a la agrupación de las formaciones redes cristalinas y se define en cristalografia por tres vectores concurrentes en un origen y los tres ángulos que forman estos entre ellos.
Las cristalinas mas usuales en los metales para uso industrial son:
- Red cúbica centrada (c.c.): hierro alfa, cromo, titanio, molibdeno, etc.
- Red cúbica de caras centradas (c.c.c.): hierro gamma, cobre, aluminio, oro, plomo, níquel, etc.
- Red hexagonal compacta (e.c.): magnesio, cinc, cadmio, etc.
También se emplea la abreviatura inglesa para designar las redes cristalinas:
-Red cúbica centrada BCC.
-Red cúbica de caras centradas FCC.
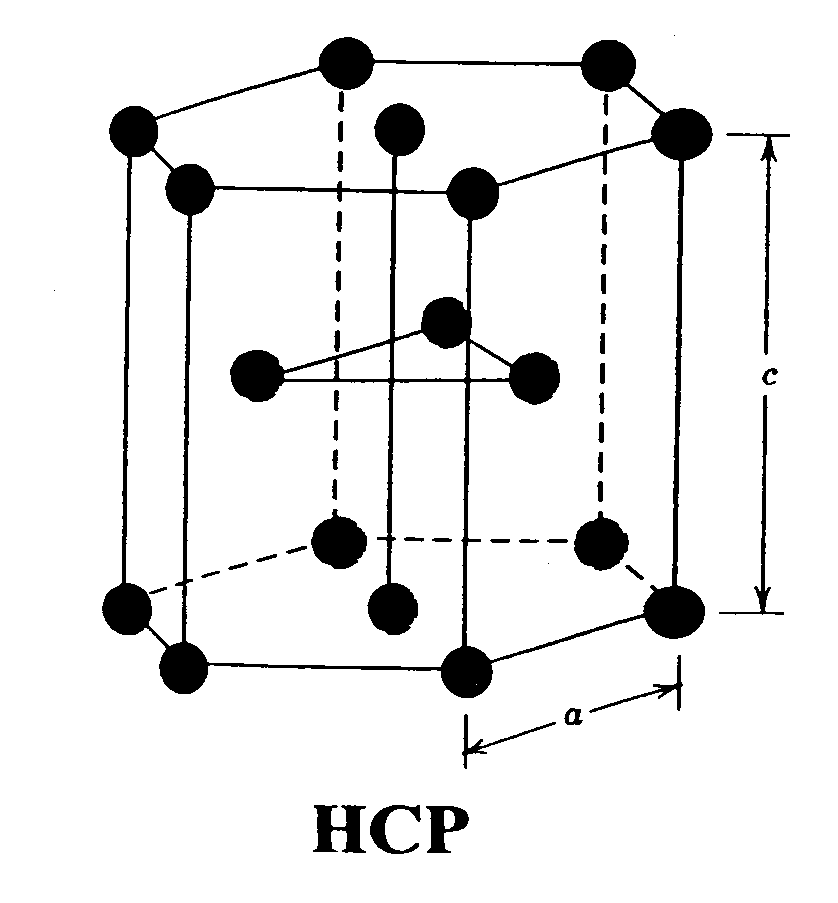
-Red hexagonal compacta HCP.
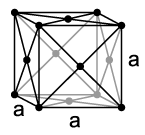
RED CÚBICA CENTRADA: los átomos se hallan dispuestos en los vértices y en el centro del cubo.
-Átomos por celdilla: 2 (1 en el centro más otro que comparte con los ocho vértices).
-Indice de coordinación: 8 átomos (el átomo central equidista de los 8 vértices).
-Arista de la celda unitaria: a = 4r/√3
-Factor de empaquetamiento: 0,68 (el 68% del volumen de la celda unitaria está ocupada por átomos).
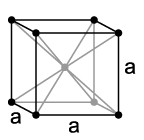
RED CÚBICA CENTRADA EN LAS CARAS: los átomos están dispuestos en los vértices y en los átomos de las caras del cubo.
-Átomos por celdilla: 4
-Indice de coordinación: 12 átomos.
-Arista de la celda unitaria: a = 4r/√2
-Factor de empaquetamiento: 0,74 (el 74% del volumen de la celda unitaria está ocupada por átomos, por tanto los metales que cristalizan según esta red poseen mayor densidad y son más resistentes que los anteriores).
RED HEXAGONAL COMPACTA: En esta red, los átomos se sitúan en los vértices de un prisma hexagonal, además uno en cada base y tres en un plano horizontal en el centro del prisma.
-Indice de coordinación: 12 átomos.
-Átomos por celdilla: 6
-Arista de la celda unitaria: a = 2R
-Factor de empaquetamiento: 0,74
Los metales que se emplean en las industrias en su mayoría se suelen usar aleaciones ya que las aleaciones permiten mejorar las propiedades físicas del material.
Las aleaciones son mezclas metálicas obtenidas con metales que al estado de fusión son solubles entre ellos ya sea en parte o en todas las proporciones.
Para obtener el acero primero se necesita conseguir el hierro ya que a partir del mineral de hierro es de donde se obtiene el acero, el hierro también hay que conseguirlo por lo que se usará un alto horno qué es un dispositivo que se emplea para extraer el hierro a partir del mineral.
Este proceso lo que se hace es una reducción de los óxidos de hierro para conseguir el hierro; en este proceso el coque que actúa a la vez como combustible y como agente reductor.
Los primeros altos hornos datan de finales de la Edad Media; ymediante una construcción que tenía forma de chimenea se intensificaba la combustión haciendo pasar un flujo de aire forzado por una serie de capas alternadas de coque, caliza y hierro de mineral.
Hasta el siglo XVIII, en lugar de coque q se empleaba carbón vegetal es por esto que el uso masivo de este combustible causo una gran deforestacion en Europa.
Durante este proceso lo que ocurre es que el coque al arder libera monóxido de carbono, y la caliza por otra parte se emplea como fundente para eliminar las impurezas del hierro y convertirlas en Escorial, y aparte también se usa como fuente adicional de monóxido de carbono.
El uso de oxígeno puro en la fabricación de acero comenzó justo antes del estallido de la Segunda Guerra Mundial, principalmente en austria y fuera de las grandes corporaciones líderes del sector. Las investigaciones conducen al desarrollo del proceso LD( Lindz-Donawitz) o de oxígeno básico, con el que actualmente se fabrica la mayor parte del acero mundial.
El horno LD es una adaptación del convertidor Bessemer, que a diferencia de este, que empleaba aire para quemar las impurezas del acero y el exceso de carbono del arrabio, el horno LD empleo oxígeno puro. En el proceso siderurgico, el arrabio fundido se transporta al horno en un tren lanzadera y el horno y el horno LD se rellena aproximadamente con un 30% de chatarra. Se introduce la lanza y se inyecta un flujo de oxígeno puro a velocidad elevada; en este proceso reacciona con el carbono y las impurezas del arrabio y la chatarra en las que se encuentra silicio, manganeso, fósforo, etc y se oxidan.
El contenido de carbono del arrabio desciende linealmente con la inyeccion del oxígeno, lo que permite efectuar el afino necesario.

Gracias a esto se consiguen aceros de diversos porcentajes de carbono cómo es el acero de bajo contenido en carbono menos de 0,20% de carbono y se usa generalmente para aplicaciones generales cómo pueden ser raíles ferroviarios, piezas de automóvil, acero de construcción, etc... ; Aceros de contenido medio que estan entre un 0,20 y 0,50 %de carbono que se usa generalmente para componentes de maquinaria que requieren una mayor resistencia. Y aceros de alto contenido en carbono que tienen más de un 0,50% de carbono se usa generalmente para herramientas o piezas especialmente resistentes al desgaste.
El tiempo que se necesita para procesar una carga de 200 toneladas de acero es alrededor de unos 20 minutos. Cuando se extrae el acero fundido a la cuchara se añaden aditivos para mejorar las propiedades del metal. Alguno de esos aditivos más habituales suelen ser:
Esta propiedad de tener diferentes estructuras de grano con la misma composición química se llama poliformismo y es por lo que se usan tratamientos térmicos.
El aluminio es un metal que es muy abundante en la corteza terrestre. El aluminio se consigue de la naturaleza a través del mineral de la bauxita que es una roca sedimentaria compuesta por alúmina y por hidróxido de aluminio.

La extracción del metal puro, es decir, el aluminio a partir de la bauxita es un proceso bastante complejo que consta generalmente de 3 pasos.
El primero es el lavado y la pulverización de la bauxita, el segundo es la transformación de la bauxita en alúmina pura mediante el proceso Bayer que disuelve lo disuelve en una solución de sosa cáustica. Tercero y último, se lleva a cabo la electrolisis para separar el óxido de aluminio en sus elementos.
El aluminio como ya sabréis tiene una buena conductividad térmica y eléctrica. Es un material muy maleable y aunque posee una resistencia mecánica relativamente baja, puede alearse y someterse a tratamientos térmicos compitiendo así con los aceros, especialmente en aquellas aplicaciones en las que el peso es un factor importante.

La industria del aluminio avanzado a velocidades muy grandes pasando de una produccion de apenas unas decenas de kilogramos en 1859 a una producción estimada de aluminio puro en 2008 de 25,6 millones de toneladas.
Se cree que alrededor de un 75% de todo el aluminio que se ha producido a lo largo de la historia sigue todavía en uso siendo así un ejemplo de que que a pesar de su abundancia en la naturaleza el aluminio es un metal relativamente joven.
Ahora vamos a contar un poco de la historia del aluminio ya que Hand Christian Oerstedfue el primero capaz de aislar el aluminio en el año 1825, aunque no totalmente puro, y es por eso por lo que se pone en duda el logro, lo que hizo fue reaccionar una amalgama de potasio sobre cloruro de aluminio, despues del cambio, destiló en vacío la nueva amalgama para eliminar el mercurio. Fue ya en 1827 friedrich Wohler en conseguir claramente y de manera repetida la separación del aluminio por reduccion del cloruro de aluminio por el potasio con lo que obtiene un polvo gris de aluminio el cual tiene presencia de óxidos y de impurezas que impiden recogerlo en una sola masa. Después de mejorar su método y ya en 1845,conseguía pequeños glóbulos de un metal suficientemente puro para describir correctamente las propiedades del aluminio.
Las aleaciones son mezclas metálicas obtenidas con metales que al estado de fusión son solubles entre ellos ya sea en parte o en todas las proporciones.
El acero
El acero posee un contenido de carbono que oscila entre el 0,2 y el 1,5%; con este porcentaje de carbono, e.l metal presenta unas propiedades que combinan dureza y maleabilidad.Hasta el siglo XVIII, en lugar de coque q se empleaba carbón vegetal es por esto que el uso masivo de este combustible causo una gran deforestacion en Europa.
Durante este proceso lo que ocurre es que el coque al arder libera monóxido de carbono, y la caliza por otra parte se emplea como fundente para eliminar las impurezas del hierro y convertirlas en Escorial, y aparte también se usa como fuente adicional de monóxido de carbono.
El uso de oxígeno puro en la fabricación de acero comenzó justo antes del estallido de la Segunda Guerra Mundial, principalmente en austria y fuera de las grandes corporaciones líderes del sector. Las investigaciones conducen al desarrollo del proceso LD( Lindz-Donawitz) o de oxígeno básico, con el que actualmente se fabrica la mayor parte del acero mundial.
El horno LD es una adaptación del convertidor Bessemer, que a diferencia de este, que empleaba aire para quemar las impurezas del acero y el exceso de carbono del arrabio, el horno LD empleo oxígeno puro. En el proceso siderurgico, el arrabio fundido se transporta al horno en un tren lanzadera y el horno y el horno LD se rellena aproximadamente con un 30% de chatarra. Se introduce la lanza y se inyecta un flujo de oxígeno puro a velocidad elevada; en este proceso reacciona con el carbono y las impurezas del arrabio y la chatarra en las que se encuentra silicio, manganeso, fósforo, etc y se oxidan.
El contenido de carbono del arrabio desciende linealmente con la inyeccion del oxígeno, lo que permite efectuar el afino necesario.

Gracias a esto se consiguen aceros de diversos porcentajes de carbono cómo es el acero de bajo contenido en carbono menos de 0,20% de carbono y se usa generalmente para aplicaciones generales cómo pueden ser raíles ferroviarios, piezas de automóvil, acero de construcción, etc... ; Aceros de contenido medio que estan entre un 0,20 y 0,50 %de carbono que se usa generalmente para componentes de maquinaria que requieren una mayor resistencia. Y aceros de alto contenido en carbono que tienen más de un 0,50% de carbono se usa generalmente para herramientas o piezas especialmente resistentes al desgaste.
El tiempo que se necesita para procesar una carga de 200 toneladas de acero es alrededor de unos 20 minutos. Cuando se extrae el acero fundido a la cuchara se añaden aditivos para mejorar las propiedades del metal. Alguno de esos aditivos más habituales suelen ser:
- El cromo que mejora la dureza, la resistencia y la resistencia al desgaste del acero.
- El manganeso que incrementa la resistencia y la dureza del acero.
- El molibdeno que incrementa la tenacidad del metal y la dureza en caliente.
- El níquel que mejora la resistencia y la tenacidad del acero.
- El vanadio que evita el crecimiento del grano en los tratamientos térmicos incrementando así la resistencia y la tenacidad del acero.
El aluminio
El aluminio es un metal que es muy abundante en la corteza terrestre. El aluminio se consigue de la naturaleza a través del mineral de la bauxita que es una roca sedimentaria compuesta por alúmina y por hidróxido de aluminio. 
La extracción del metal puro, es decir, el aluminio a partir de la bauxita es un proceso bastante complejo que consta generalmente de 3 pasos.
El primero es el lavado y la pulverización de la bauxita, el segundo es la transformación de la bauxita en alúmina pura mediante el proceso Bayer que disuelve lo disuelve en una solución de sosa cáustica. Tercero y último, se lleva a cabo la electrolisis para separar el óxido de aluminio en sus elementos.
El aluminio como ya sabréis tiene una buena conductividad térmica y eléctrica. Es un material muy maleable y aunque posee una resistencia mecánica relativamente baja, puede alearse y someterse a tratamientos térmicos compitiendo así con los aceros, especialmente en aquellas aplicaciones en las que el peso es un factor importante.

La industria del aluminio avanzado a velocidades muy grandes pasando de una produccion de apenas unas decenas de kilogramos en 1859 a una producción estimada de aluminio puro en 2008 de 25,6 millones de toneladas.
Se cree que alrededor de un 75% de todo el aluminio que se ha producido a lo largo de la historia sigue todavía en uso siendo así un ejemplo de que que a pesar de su abundancia en la naturaleza el aluminio es un metal relativamente joven.
Ahora vamos a contar un poco de la historia del aluminio ya que Hand Christian Oerstedfue el primero capaz de aislar el aluminio en el año 1825, aunque no totalmente puro, y es por eso por lo que se pone en duda el logro, lo que hizo fue reaccionar una amalgama de potasio sobre cloruro de aluminio, despues del cambio, destiló en vacío la nueva amalgama para eliminar el mercurio. Fue ya en 1827 friedrich Wohler en conseguir claramente y de manera repetida la separación del aluminio por reduccion del cloruro de aluminio por el potasio con lo que obtiene un polvo gris de aluminio el cual tiene presencia de óxidos y de impurezas que impiden recogerlo en una sola masa. Después de mejorar su método y ya en 1845,conseguía pequeños glóbulos de un metal suficientemente puro para describir correctamente las propiedades del aluminio.
No hay comentarios:
Publicar un comentario